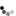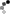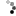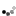立命館大學生命科學部白壁京子教授的研究小組與東京醫科齒科大學、九州大學和大阪大學合作,闡明了膜蛋白特定區域的氨基酸序列決定其胞外結構域脫落(以下簡稱脫落)的易感性。這項研究成果發表在學術期刊《生物化學雜誌》上,並被選為錄用率約2%的「編輯推薦」。本研究是日本醫療研究開發機構國家研究開發機構創新先進研究與開發支持計劃(AMED-CREST)的研究與開發項目“闡明由細胞間相互作用和器官代謝網絡崩潰引起的組織纖維化的控制機制及其醫療應用”(主要研究者:小川善弘)的一部分進行的。
「脫落」是指胞外結構域*1從嵌入細胞膜的膜蛋白上分離,這是一種強大的分子機制,它不僅會改變被切割蛋白的功能,還會改變表達該蛋白的細胞的功能。
這項研究表明,在胞外結構域膜附近含有大量「帶負電荷的氨基酸」的膜蛋白可以避免脫落。
這或將促進開發各種與脫落有關的疾病的治療方法,例如發炎性疾病、癌症和神經退化性疾病。
研究領域背景
細胞膜上包裹著具有各種功能的膜蛋白,細胞所能發揮的功能因包裹其中的膜蛋白類型而異。白壁教授及其團隊正在研究的「脫落」是一種將暴露在細胞外的膜蛋白部分分離的分子機制(圖1),它是一種透過改變細胞表面膜蛋白庫來改變細胞功能的強大機制。此外,許多引起發炎的細胞激素和促進細胞增殖的生長因子都是以膜蛋白的形式產生的,然後脫落,並且只有在脫落後才能全身發揮作用,因此脫落是細胞間通訊的基礎。脫落是由嵌入膜中的裂解酶*2(圖1,剪刀)進行的,但這種酶不具有識別和裂解特定氨基酸序列的特性,而且,目前對有限的膜蛋白如何脫落的了解甚少。
主要發現
當免疫細胞巨噬細胞識別細菌成分並被活化時,它們會脫落並釋放發炎細胞因子。在先前的研究中,Shirakabe教授及其團隊透過活化巨噬細胞脫落和釋放的膜蛋白進行蛋白質體學篩選,發現黏附分子ALCAM(活化白血球黏附分子)會脫落。本研究透過分析兩種透過選擇性剪接產生的ALCAM變異體*3,揭示了一種意想不到的脫落控制機制。這兩種ALCAM變異體的產生取決於在脫落發生的膜附近是否插入了一段佔分子整體3%以下的短胺基酸序列(圖2頂部的紅線)。結果發現,插入的ALCAM不會脫落,而未插入的ALCAM則會脫落(圖2)。我們假設這段短序列含有某種抑制脫落的元件,經過詳細分析發現,該序列中近一半是帶負電荷的氨基酸(圖2上方綠色圓圈),當這些帶負電荷的氨基酸被不帶電荷的氨基酸取代時,就會發生脫落。 Shirakabe教授團隊先前已報道,只有在脫落裂解位點沒有糖鏈的CADM1變體才會對另一種名為CADM1(細胞黏附分子1)的黏附分子產生脫落。結合這項發現以及本研究的結果,我們提出了一個關於脫落控制機制的新思路:維持脫落特異性的機制並非透過選擇對負責脫落的裂解酶有利的膜蛋白,而是透過選擇「沒有抑制元件的膜蛋白」(圖3)。
圖 1:胞外結構域脫落
胞外結構域透過同樣嵌入細胞膜的裂解酶(剪刀)從嵌入細胞膜的膜蛋白上分離。

圖2:帶負電荷的胺基酸抑制脫落。當裂解酶識別細菌成分時,它會被激活,但在帶負電荷的氨基酸存在的情況下,裂解不會發生。

圖 3:抑制劑維持的脫落特異性
ALCAM 被帶負電荷的胺基酸(圖中綠色圓圈)抑制,而 CADM1 被聚醣(圖中虛線)抑制,因此只有那些有空間容納裂解酶的聚醣才會脫落。

未來發展及對社會的影響
一些脫落的膜蛋白參與了發炎的誘發和癌症的發展。此外,已知導致阿茲海默症的膜蛋白會脫落並在腦內積聚。透過闡明脫落發生和不發生的時間的控制機制,有望開發出針對這些疾病的新治療方法。特別是,脫落酶厭惡負電荷的發現表明,可以透過某種方式將負電荷帶到細胞表面來抑制脫落。目前的COVID-19疫情也被認為是由失控的全身性發炎反應引起的。我們希望透過建立一種抑制脫落的方法,為各種疾病的治療方法的發展做出貢獻。
術語
*1 胞外結構域
各種蛋白質嵌入脂質細胞膜,細胞的功能因嵌入蛋白質的類型而異。蛋白質嵌入膜中暴露於細胞外部的部分稱為胞外結構域,它可作為細胞與外界之間的介面。
*2 裂解酶
脫落主要由 ADAM(一種解整合素和金屬蛋白酶)家族完成,該家族是一種跨膜蛋白質降解酶(蛋白酶),其活性中心位於細胞外。本研究也揭示了 ADAM 家族具有「在距膜固定距離處切割」的特性。我們認為,膜蛋白是否脫落取決於 ADAM 家族可能切割的位置是否有抑制脫落的元件。
*3 變體
基因的結構是多個「外顯子」(構成蛋白質的藍圖)夾在「內含子」(不會變成蛋白質)之間。這些外顯子的選擇稱為選擇性剪接,而由於選擇性剪接而由單一基因產生的具有不同外顯子配置的蛋白質稱為變異。